Nemoci prsu
MUDr. Pavel Strnad, CSc.
Gynekologicko-porodnická klinika 2.LF UK a FN Motol
Úvod
Karcinom prsu je nejčastější neoplázií u ženy a představuje tak významný medicínský a společenský problém. Jeho incidence v rozvinutých zemích dramaticky vzrůstá a bohužel Česká Republika z hlediska incidence karcinomu prsu k nim již dlouho patří. V tabulce 1 je uvedena incidence karcinomu prsu a mortalita od roku 1970 po pětiletých intervalech až do poslední dostupné hodnoty z roku 1997 (UZIS).
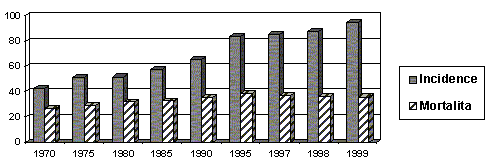 |
Z průběhu incidencí mortality na karcinom prsu došlo k určité stabilizaci v posledních 10 letech, informace z roku 1997 naznačuje velmi mírný pokles. Mortalita v roce 1997, která činí 36,7/100 000 žen je však stále vysoká. Pro srovnání, mortalita ve Spojených státech se pohybuje okolo 25/100 000 žen při mnohem vyšší incidenci.
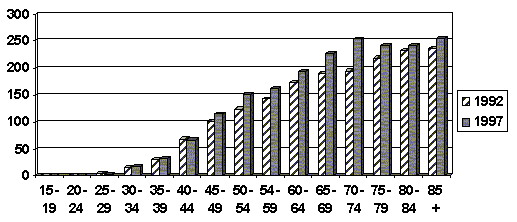
Traduje se názor o akceleraci incidence karcinomů prsu v mladších věkových kategoriích žen. Nádory prsu u mladých žen mají horší biologické vlastnosti, rostou rychleji a mají všeobecně horší prognózu než u žen postmenopauzálních. V Evropě je karcinom prsu vedoucí příčinou úmrtnosti žen do 60 roku života. Poté začínají dominovat v příčinách úmrtnosti kardiovaskulární onemocnění. Srovnání incidence karcinomu prsu v roce 1992 s rokem 1997 podle věkových skupin je znázorněno v tabulce 2 a nezdá se, že by se významně měnila distribuce výskytu v jednotlivých věkových kategoriích. Toto pozorování je podepřeno dalšími studiemi, které takový trend nezachytily.
 |
Rizikové faktory karcinomu prsu
Rizikové faktory představují heterogenní soubor různých faktorů, které v epidemiologických studiích zvyšovaly relativní riziko vývoje karcinomu prsu. Přesná etiopatogeneze tohoto onemocnění není jasná, nádory prsu jsou výrazně heterogenní skupinou a za jejich vývoj odpovídá soubor(y) různě mutovaných skupin genů. Proto mají rizikové faktory i pokusy o kvantifikaci rizika, jako např. známý Gailův model predikce rizika jen omezený individuální význam. Přehled rizikových faktorů je uveden v tabulce 3.
| Rizikový faktor | Relativní riziko | |
|---|---|---|
| 1) | Pohlaví (žena proti muži) | 183 |
| 2) | Věk (30 let proti 65 letům) | 17 |
| 3) | Atypická hyperplazie post / premenopauzálně | 4 – 6 |
| 4) | Životní region (Severní Amerika, Evropa proti Asii) | 4 – 5 |
| 5) | Karcinom prsu v osobní anamnéze | 2 – 4 |
| 6) | Radiace na oblast hrudníku v mladém věku | 2 – 4 |
| 7) | Výskyt karcinomu prsu u přímých příbuzných | 2 – 3 |
| 8) | Nuliparita nebo porod po 35. roce života | 2 – 3 |
| 9) | Menopauza po 55. roce proti menopauze před 45. rokem | 2 |
| 10) | RA ca ovaria u přímých a prsu u nepřímých příbuzných | 1,5 – 2 |
| 11) | Menarche před 12. rokem proti menarche po 15. roce | 1,5 |
| 12) | Vyšší socio-ekonomické postavení, BMI pod 25 premenopauzálně, BMI nad 35 postmenopauzálně, proliferující léze prsu | 1,5 – 2 |
Z tabulky je vidět významný rizikový vliv pohlaví – endogenních hormonů a potom věku. Karcinomy prsu jsou typické nádory staršího věku. Vliv některých rizikových faktorů se sčítá, např. kombinace výskytu karcinomu prsu u matky a sestry zvyšuje hodnotu relativního rizika na 14 nebo kombinace atypické hyperplazie v biopsii s rodinným výskytem karcinomu prsu u přímých příbuzných dosahuje relativního rizika okolo 8.
Diagnostika nemocí prsu
Symptomatologie je velmi prostá: přítomnost rezistence v prsu, retrakce bradavky, která dříve nebyla, patologická sekrece z bradavky, ekzantém a svědění bradavky (Pagetův karcinom), retrakce kůže (infiltrace Cooperových ligament tumorem), zesílení a zarudnutí kůže - peau d´ orange (přesahuje-li více jak 1/3 plochy prsu, znamená vysokou suspekci na inflamatorní karcinom prsu) nebo zduření spádových lymfatických uzlin v axile. Mastodynie bez jiných příznaků byla v epidemiologické studii spojena s přítomností karcinomu v 5-8%.
Diagnóza na základě výše uvedených příznaků je vždy diagnózou pozdní. Nádor prsu o velikosti 1cm (stadium T1b) má přibližné pěti00leté přežití 95% proti nádoru velikosti 3cm (T2) s 67% přežitím. Samovyšetřením nebo klinickým vyšetřením je možné detekovat za optimálních podmínek nádor větší než 1-1,5 cm, většinou to jsou však nádory větší 2 cm. Tyto metody umožní snížení záchytu pozdních stádií karcinomu prsu (T3, T4), nemohou významně snížit mortalitu.
Mamografie
Mamografie je vedoucí metodou v diagnostice nemocí prsu, která využívá měkké, nízkoenergetické záření. Současné mamografické přístroje detekují nádor od několika milimetrů. I při absenci viditelné formace v prsu je mamografie schopna zachytit tzv. mikrokalcifikace, které mohou být prvním příznakem nemoci. Proto je vhodnou metodou pro tzv. celoplošný screening karcinomu prsu. Vzhledem k tomu, že s věkem významně stoupá incidence karcinomu je screening zahajován po dosažení určitého věku ženy (od 50, 45, 40 let). V tomto věku již bývá dosaženo určité involuce prsu, takže senzitivita mamografie stoupá. Dobře vedené screeningové programy vedly k poklesu mortality až o 30%. Mamografie je relativně kontraindikována do 35 roku života ženy. Její senzitivita je při zobrazení prsu mladých žen výrazně nižší a je spojena s určitou, i když velmi malou radiační zátěží (0,1-0,2 rad). Přibližně 10% nádorů, především lobulárních, není mamografie schopná detekovat. Proto má klinické vyšetření prsů předcházet provedení mamografie. Diagnóza je někdy výsledkem kombinace všech dostupných metod (klinické vyšetření, mamografie, ultrazvuk).
Indikace mamografie:
- důvodné podezření patologickou formaci u ženy nad 30-35 let věku
- důvodné podezření patologickou formaci u ženy do 30-35 let věku při nejednoznačném ultrazvukovém a klinickém nálezu
- klinicky jasný karcinom prsu před zahájením léčby pro vyloučení multifokality a bilaterality procesu
- vyšetření před plastickou operací prsů k vyloučení okultního karcinomu
- před zahájením a v průběhu hormonální substituční léčby v intervalech 1-2 roky
- sledování žen alespoň s jedním významným rizikovým faktorem
- poslední dva body budou nahrazeny plánovaným mamografickým screeningem, který bude založen na věku (od 40-45 let věku každý rok, po menopauze každé 2 roky)
Duktografie
Jedná se o kontrastní vyšetření, kdy je secernující duktus nastříknut kontrastní látkou a sleduje se jeho větvení a přítomnost event. intraduktálních patologií. Duktografie je indikována u tzv. secernujícího prsu, především u jednostranné serózní a krvavé sekrece z bradavky. V těchto případech je možné očekávat intraduktální karcinom v 6-8%. Jiná barevná sekrece (od mléčné přes hnědou, zelenou po hnědou až černou) není indikací vyšetření. Duktografie má poměrně vysoké procento falešně pozitivních nálezů, proto má být velmi uvážlivě indikována.
Ultrasonografie
Ultrazvuk prsů je doplňující metoda mamografie tam, kde mamografický snímek není dobře čitelný, u žen s výraznými fibrózními změnami prsu, tzv. mastopatií. Ultrazvuk dobře diferencuje solidní lézi od cystické a je metodou volby pro detekci formací prsu u mladých žen do 30-35 roku života. Doplní nejednoznačný mamografický nález a přispívá ke snížení zbytečně prováděných biopsií pro benigní nálezy. Není schopen registrovat mikrokalcifikace a karcinomy prsu spolehlivě diferencuje až od velikosti 1 cm.
Počítačová tomografie
Vyšetření je přínosné pro event. zjištění infiltrace vnitřních mamárních, a mediastinálních lymfatických uzlin a pro posouzení vztahu nádoru k hrudní stěně. Nedetekuje mikrokalcifikace a je spojena s poměrně značnou radiační zátěží. Není vhodnou metodou pro diagnostiku časných stádií tumoru a pro screening.
MR mamografie (magnetická rezonance prsu)
Původně velmi slibná metoda. Podle mého názoru nesplnila očekávání v detekci např. multifokality tumoru - výsledky jsou srovnatelné s mamografií. Jen v případech velmi denzních prsů mladých žen se suspektním nálezem je indikována k vyloučení multifokality procesu před konzervativním výkonem. Je dobrou metodou pro diferenciaci jizvy v prsu po konzervativním výkonu od recidivy nádoru a při přítomnosti silikonových implantátů v prsu. Nevýhodou je cena vyšetření (5000 Kč), nedetekuje mikrokalcifikace, je kontraindikována při přítomnosti kovových materiálů v prsu nebo např. při klaustrofobii.
Jiné diagnostické zobrazovací metody nejsou pro rutinní diagnostiku vhodné (PET) nebo mají velmi nízkou senzitivitu i specificitu (termografie).
Cytologie
Otisková a aspirační cytologie tenkou jehlou (FNBA – fine needle breast aspiration)
Otisková cytologie a cytologie z punktátů velkých cyst nemá valný přínos. Ve shodě s ostatními cytologicky vyšetřujeme jen sanquinolentní sekreci či aspiráty. Aspirace solidních útvarů tenkou jehlou na cytologické vyšetření rovněž nedoznala většího rozšíření, i když dobrá laboratoř je schopná stanovení nejen cytotypu ale provádět i imunohistochemická vyšetření.
Punkční biopsie
Jedná se o metodu punkce tlustou jehlou (core-cut, tru-cut), většinou bioptickým „dělem“ (biopsy gun). Získán je váleček tkáně síly jehly (14 gauge), délky až 2 cm, ze kterého je možné provést již histopatologický rozbor tkáně a různá imunohistochemická vyšetření.
Tato metoda pomáhá další redukci otevřených biopsií prsu pro benigní nádory a umožňuje časnou verifikaci karcinomů před onkologickou léčbou.
Nezhoubné nemoci (změny prsu)
Do této kategorie je možné zařadit prakticky všechny léze prsu mimo karcinom. V průběhu 19-20 století bylo vytvořeno velké množství klasifikací, které zamlžují jejich podstatu a především riziko. V tabulce 4 je stručně je uvedena současná histopatologická klasifikace nezhoubných lézí prsu.
| Histopatologický typ léze | Relativní riziko karcinomu prsu | |
|---|---|---|
| A) | Epiteliální metaplastické změny (změna epitelu z plně diferencovaného v jiný) | 1 |
| B) | Cysty (patologicky dilatované prostory odvozené od epitelu obsahující tekutinu, někdy mohou obsahovat metabolicky aktivní výstelku) | 1 |
| C) | Proliferace epiteliální složky (zvýšené množství, proliferace glandulárních komponentů) - adenozy, radiální jizva, epiteliální hyperplazie mírné a střední - epiteliální hyperplazie těžká - atypická hyperplazie | 1 2 – 3 4 – 6 |
| D) | Epiteliální proces má papilární charakter (papilom - fibrovaskulární jádro kryté epitelem) | 1 – 1,5 |
| E) | Proliferační proces postihuje současně epiteliální i stromální složku - fibroadenom | 1 |
| F) | Proliferace postihuje převážně stromální složku - phyllodes tumor (cystosarcoma phyllodes) | v 6 % sarkom |
| G) | Vzácně se vyskytující nádory - hamartomy (fibroadenolipom a další) | 1 |
| H) | Zánětlivé, reaktivní a jiné změny - duktektázie, tuková nekróza | 1 |
Z celé škály nezhoubných lézí prsu pouze atypická hyperplazie epitelu (duktální i lobulární) významně zvyšuje riziko karcinomu prsu. Frekvence této entity je odhadována na 5-8% všech lézí prsu a je považována za prekancerózu. Její riziko je vyšší u premenopauzálních žen, zde je předpokládán vliv endogenních hormonů. Riziko této léze klesá po biopsii do 10 let na úroveň normálního populačního rizika karcinomu prsu. Epiteliální buňky atypické hyperplazie mají všechna kritéria malignity jako má karcinom in situ, nemají však jeho charakteristický růstový vzorec. Někdy je velmi obtížné odlišit atypickou hyperplazii od karcinomu in situ, některé studie považují atypickou hyperplazii za variantu low-grade karcinomu in situ.
Americký patolog Page navrhl rozdělení nezhoubných lézí prsu podle jejich vztahu k riziku karcinomu, které je jednoduché, výstižné a běžně užívané.
- Neproliferující léze – do této skupiny patří většina lézí prsu včetně cyst, polypů a fibroadenomu – riziko karcinomu prsu není zvýšené RR = 1
- Proliferující léze bez atypií - jedná se převážně o významné a těžké hyperplazie duktálního epitelu a o mnohočetnou papilomatozu, RR = 1,5
- Atypická hyperplazie - RR = 4 – 6
Karcinomy in situ - riziko invazivního karcinomu
Mezi preinvazivními karcinomy duktálními (DCIS) a lobulárními (LCIS) je podstatný rozdíl v jejich biologickém chování. Latentní období mezi detekcí mikroskopického karcinomu in situ (duktální, lobulární) a vývojem invazivního karcinomu je odhadováno na 10 - 15 let. Nevznikne-li karcinom v této době pak se riziko výrazně snižuje.
Duktální karcinom in situ (DCIS)
DCIS není jedna samostatná jednotka, nýbrž značně heterogenní skupina s rozdílnými histologickými charakteristikami, které mají vliv na jeho biologickými vlastnosti. Z hlediska prognózy je možné DCIS rozdělit na tři skupiny vysokého, středního nebo nízkého rizika. Přítomnost nekrózy a komedo typ znamená vyšší riziko recidivy. Jedna z klasifikací na léze vysokého a nízkého rizika (high a low grade) používá terminologii komedo DCIS a non- komedo DCIS. V tabulce 5 jsou uvedena kritéria pro základní rozlišení DCIS.
| Grading | Histologie | Nekróza | Aneuploidie | Jaderný grade | c-erbB2 |
|---|---|---|---|---|---|
| vysoký | komedo | výrazná | 100% | vysoký | + (ve 45%) |
| střední | směs* | fokální (chybí) | 80% | střední | + / - |
| nízký | non-komedo** | chybí | 45% | nízký | negativní |
* - kombinace komedonového s jiným typem, často mix nekomedonových typů DCIS
** - solidní, kribriformní, papilární růstový vzorec
Duktální karcinom in situ je považován za jasnou prekurzorovou lézi invazivního karcinomu prsu. V případech DCIS, který byl léčen pouhou biopsií došlo ve 25-30% k vývoji invazivního karcinomu v ipsilaterálním prsu. Recidiva se objevovala v tom samém kvadrantu prsu nebo v místě původní biopsie. V těchto případech se průměrná doba od diagnózy DCIS do diagnózy invazivního karcinomu pohybovala od 5ti do 10ti let. Tento poměrně krátký latentní interval (DFI – interval bez příznaků nemoci) platí pro high grade léze (komedonový DCIS). Low grade DCIS (nekomedonový DCIS) má podstatně delší interval bez nemoci. K vývoji invazivního karcinomu docházelo ve 37% případů až po 15-25 letech. Riziko vývoje invazivního duktálního karcinomu nebylo modifikováno menopauzou. V případech nehmatného nekomedonového DCIS bývá recidiva pozorována pouze ve 2% případů. Frekvence postižení axilárních lymfatických uzlin se pohybuje okolo 1 %, proto v případě DCIS není axilární lymfonodektomie doporučována.
Management DCIS
Pro management DCIS má vedle histopatologických kritérií význam rozlišit, jde-li o lézi hmatnou nebo o nehmatný, mikroskopický preinvazivní karcinom. Hmatná léze, i když ještě je preinvazivním karcinomem má vyšší frekvenci multifokality (více samostatných ložisek), vyšší jaderný grade, vyšší incidenci mikroinvaze (okultní invaze). Mastektomie jako tradiční metoda léčby DCIS je indikována v případech vysoce rizikových lézí, u intraduktálních karcinomů šířících se na velkou vzdálenost prsem, u multifokálních lézí, avšak také u gigantomastie, pendulujících prsů, kde radioterapeut nemůže zajistit adekvátní radioterapii. Ve většině případů je postačující široká excize s lemem zdravé tkáně doprovázená radioterapií. Radioterapie podstatně snižuje riziko recidivy.
Lobulární karcinom in situ (LCIS) - lobulární neoplazie
V současné době se označuje lobulární karcinom in situ společně s atypickou lobulární hyperplazií novým termínem „lobulární neoplazie“. LCIS je považován za marker vysokého rizika vývoje invazivního karcinomu nikoli za prekurzorovou lézi jako DCIS.
Toto tvrzení je podporováno mnoha nálezy. Průměrný věk výskytu LCIS je o 5-15 let nižší než průměrný věk výskytu invazivních karcinomů prsu a bývá diagnostikován náhodně při biopsii z jiných důvodů. Mezi pacientkami s diagnostikovaným LCIS se v průběhu dalších 25ti let ve 25% případů vyvinul invazivní karcinom. Průměrný interval od diagnózy LCIS do vývoje invazivního karcinomu prsu byl 15–20 let. Avšak 65% všech invazivních karcinomů, které se vyvinuly po biopsii LCIS bylo duktálních. Jestliže má být LCIS pravá prekurzorová léze, pak by všechny invazivní karcinomy měly být lobulární a přinejmenším v ipsilaterálním prsu jako původní léze. Frekvence výskytu následného invazivního karcinomu prsu však byla stejná pro oba prsy. Pro lobulární karcinom in situ (v menší míře i pro invazivní lobulární karcinom) je typická vysoká incidence multicentrického vzniku (až v 90%) a bilateralita (až v 70%). Lymfatické axilární uzliny nebývají postiženy.
Vzhledem k těmto biologickým rozdílům, nelze LCIS považovat za prekurzorovou lézi nýbrž pouze za marker vysokého rizika vývoje invazivního karcinomu jakéhokoli typu, kdekoli v obou prsech a relativní riziko je odhadováno na 10-12. Výskyt rodinné anamnézy karcinomu prsu v první linii příbuzných zdvojnásobí riziko základní léze. Tabulka 6 uvádí prognózu a riziko vývoje invazivního karcinomu po pouhé biopsii LCIS.
| Autor | Počet případů | Délka sledování | Počet recidiv | Ipsi/Kontralat. lokal. | RR |
|---|---|---|---|---|---|
| Rosen | 81 | 24 let | 24 (29,6%) | 1:1 | 9,0 |
| Haagensen | 285 | 16 let | 53 (18,5 %) | 1,2:1 | 5,9 |
Management LCIS
Vzhledem k biologickým vlastnostem není mastektomie indikována, stejně tak jako kombinace mastektomie a biopsie kontralaterálního prsu. Incidence invazivního karcinomu je stejná i ve druhostranném prsu, proto postrádá smysl i kombinace široké resekce s radioterapií prsu. Zde je zapotřebí vzít do úvahy i kancerogenní účinek radioterapie. Výhrady jsou vůči subkutánní mastektomii. Goodnight pozoroval dokonce zvýšenou incidenci karcinomu prsu u žen, které podstoupily tento výkon. Takže jediným chirurgickým výkonem, kterým je možné významně redukovat riziko recidivy invazivního karcinomu, je oboustranná profylaktická mastektomie (event. s okamžitou rekonstrukcí). Tento invazivní a mutilující zákrok je při relativním riziku vývoje karcinomu prsu 10 nanejvýš diskutabilní, obhájit jej lze při výrazné genetické zátěži rodiny a u nositelek mutací genů BRCA 1,2.
V současné době je preferována pečlivá dispenzarizace ženy. V případě pozitivity hormonálních receptorů, která je přítomná ve většině případů LCIS je metodou volby podávání antiestrogenů.
Invazivní karcinomy
Duktální karcinom
Tvoří 70–85% všech maligních nádorů prsu. Jeho prognóza je vázána na stadium nádoru při jeho diagnóze. Duktální karcinom metastazuje především do kostí, parenchymatosních orgánů (játra, plíce) a do mozku.
Lobulární karcinom
Lobulární karcinom je jen o něco tužší než okolní tkáň, nemá jasné ohraničení, neobsahuje jiné abnormality (nekróza, cysty, hemoragie) a netvoří mikrokalcifikace. To vše činí i mamografickou diagnostiku velmi obtížnou. Lobulární karcinom představuje 10–14% všech invazivních karcinomů prsu. Prognóza lobulárního karcinomu a pravděpodobnost metastáz v regionálních lymfatických uzlinách je podobná jako u karcinomu duktálního. Lobulární karcinom stadia T1N0M0 má desetiletou mortalitu přibližně 6% oproti duktálnímu karcinomu stejného stadia, který ji má 14%. Lobulární karcinom přednostně metastazuje do meningeálních prostor CNS (karcinomatosní meningitis), na serosní povrchy (peritoneum) a do retroperitonea. Metastázy v GIT napodobují karcinom žaludku a jsou i histologicky obtížně rozlišitelné od primárního karcinomu žaludku. Lobulární karcinom může metastazovat do ovarií a dělohy.
Tubulární karcinom
Jeho incidence je pouze 2% všech invazivních karcinomů Velikost kolísá mezi 0,2 až 4 cm, přičemž více než 80% tubulárních karcinomů bylo menších než 1cm. Tubulární karcinom má velmi dobrou prognózu pokud je tvořen tubulárními elementy nejméně v 75%, nebo při velikosti primárního tumoru pod 1 cm. V těchto případech nebývají lymfatické axilární uzliny tumorem postiženy.
Medulární karcinom
Frekvence výskytu je menší než 10% a častěji je nalézán u mladších žen ve věkovém rozmezí 46-54 let. Může být zaměněn zobrazovacími metodami i makroskopicky za fibroadenom a představuje prognosticky příznivý typ karcinomu.
Mucinózní - koloidní karcinom
Tvoří asi 1-6% všech invazivních karcinomů. Čistý mucinózní tumor má velmi dobrou prognozu a téměř vždy desetileté přežití. Recidivy a úmrtí se vyskytují až po 10 – 20ti letech od operace
Papilární karcinom
Papilární karcinom tvoří 0,3–3% všech karcinomů prsu Přibližně ve 22–34% je přítomen výtok z bradavky. Nádor mívá obvykle velmi dobrou prognózu.
Speciální typy karcinomu prsu
Pagetova nemoc bradavky (Pagetův karcinom)
Je typický svěděním, pálením bradavky a/nebo povrchní erozí či ulcerací. Představuje přibližně 1% všech karcinomů prsu Je-li nádor omezen na bradavku a není-li hmatný, pak frekvence postižení lymfatických uzlin bývá okolo 5% a pěti, desetileté přežití se pohybuje okolo 92% resp. 87%. Avšak při existenci již hmatné nádorové hmoty klesá přežití na 45% resp. 38%.
Inflamatorní – zánětlivý karcinom
Zánětlivý karcinom prsu představuje nejmalignější typ nádoru prsu. Tvoří 3% všech karcinomů a vyskytuje se převážně u postmenopauzálních žen. Klinicky je charakterizován zvětšením, bolestí prsu a erytémem (peau d´orange), edémem kůže prsu a zvýšením lokální teploty. Mikroskopicky se jedná o variantu duktálního karcinomu, který je nediferencovaný a šíří se převážně lymfatickými cévami.V čase diagnózy bývají téměř vždy již přítomné metastázy v regionálních lymfatických uzlinách. Prognóza je velmi špatná, přes pokroky v chemoterapii a radioterapii přežívá pět let pouze okolo 30% pacientek.
Prognostické faktory karcinomu prsu
V tabulce 7 je uveden vztah mezi velikostí tumoru, pěti a desetiletým přežitím a postižením lymfatických uzlin 13 466 pacientek (National Cancer Institut) a 1692 pacientek New York Medical College Affilated Hospitals.
| Velikost nádoru | Pětileté přežití | Desetileté přežití | Postižení lymfatických uzlin |
|---|---|---|---|
| T1 pod 1 cm | 98,3 % | 94,9% | 24,7% |
| T1 nad 1 cm | 92,3 % | 73,9% | 34,1% |
| T2: | - | 43,7% | - |
| 2,0 – 2,9 cm | 90,6 % | - | 42,1% |
| 3,0 – 3,9 cm | 86,2 % | - | 50,1% |
| 4,0 – 4,9 cm | 84,6 % | - | 56,5% |
| T3 | 82,2 % | 20% | 64,5% |
Průměrné desetileté přežití při negativním nálezu v lymfatických uzlinách bez ohledu na velikost tumoru je 75%, při postižení 1-3 lymfatických uzlin je 38% a při postižení čtyř a více uzlin je jen 13%. Při výskytu metastázy v jedné lymfatické uzlině je procento přežití jen o málo nižší než při negativním nálezu. Imunohistochemicky detekované mikrometastázy v lymfatických uzlinách při negativním nálezu klasickou metodou se vyskytují až ve 30%. V současnosti nejsou zprávy, že by tento nález podstatně zhoršil prognózu pacientek.
Management invazivního karcinomu prsu
Diagnostika a léčba karcinomu prsu je výsledkem práce multidisciplinárního týmu odborníků.
Chirurgická léčba je léčbou lokoregionální, při které se odstraňuje nádorové ložisko a regionální lymfatické uzliny. Standardním výkonem je modifikovaná radikální mastektomie nebo v indikovaných případech konzervativní-prs šetřící výkon, který se označuje jako parciální mastektomie, kvadrantektomie, lumpektomie, segmentektomie či široká resekce tumoru. V podstatě jde o odstranění nádoru s lemem zdravé tkáně prsu bez tumoru. I tento výkon se doplňuje exenterací axilárních lymfatických uzlin z druhé incize v axile.
Podmínky pro provedení konzervativní operace:
- nádor menší než 4 cm
- optimální vztah mezi velikostí tumoru a prsu, který podmiňuje výsledný kosmetický efekt. U malých prsů může někdy konzervativní výkon představovat podstatné odstranění hmoty prsu a po následující radioterapií bývá kosmetický efekt špatný. Naopak u objemných a pendulujících prsů je i při malém nádoru velmi obtížné zajistit adekvátní radioterapii.
- absence multifokality nádoru a difúzních mikrokalcifikací
- intraduktální komponenta nádoru nemá přesahovat 20-25%
- nádor je blízko centra prsu - ve vzdálenosti nádoru do 3 cm od centra je poměrně vysoké riziko (až 35%) přítomnosti metastáz v mamile.
Indikací chirurgické léčby je nádor I a II stádia. U vyšších stádií nemoci je léčba po potvrzení diagnózy zahajována léčbou systémovou – chemoterapií a chirurgický výkon je zařazen do systému komplexní terapie.
Koncepce tzv. neoadjuvantní chemoterapie začíná po stanovení diagnózy karcinomu prsu léčbou systémovou i u operabilních stádií karcinomu prsu, která je následována léčbou chirurgickou. Názory na tuto modalitu léčby nejsou zatím jednoznačné.
V současné době je trend provádět chirurgický výkon v jedné době, to znamená exstirpaci tumoru, rychlé histologické zpracování v průběhu operace a dle jeho výsledku adekvátní operace. Druhý směr je získání diagnózy punkční biopsií nádoru a na základě výsledku definitivní chirurgické řešení. Výhodou tohoto postupu je to, že odpadá čekání na operačním sále na výsledek rychlé histologie.
Axilární lymfonodektomie
Patří ke standardu chirurgie invazivního karcinomu prsu. Má význam jednak pro staging a prognózu a v případech postižení lymfatických uzlin nádorem i pro regionální kontrolu nemoci. V současné době se provádí lymfonodektomie jen z I a II etáže lymfatických uzlin – to znamená laterálně a pod musculus pectoralis minor.
Pro pacientku znamená exenterace axily zvýšené riziko otoku nebo lymfedému horní končetiny v důsledku omezení lymfatické drenáže. Ženy nemají příslušnou horní končetinu nadměrně zatěžovat a vyvarovat se prudkých tepelných změn (sauna). Nedoporučuje se zde provádět měření krevního tlaku, odběry krve nebo intravenózní injekce. Je zde zvýšené riziko zpomaleného hojení každého poranění.
Z těchto důvodů je vyvíjen koncept selektivní exstirpace tzv. sentinelové lymfatické uzliny. Ten znamená, že v axile jsou přítomny 2-3 lymfatické uzliny-strážci (sentinelové uzliny), do kterých se šíří karcinom jako první. Odstraníme li tyto uzliny a budou-li bez metastáz tumoru, pak se můžeme vyhnout kompletní axilární lymfonodektomii. Tyto uzliny se v současné době detekují peroperačně buď lymfoscintigrafií a/nebo obarvením lymfotropním barvivem (patent blau).
Karcinom prsu je systémové onemocnění a většinou jsou v době diagnózy přítomny tzv. mikrometastázy v organismu. Tento fakt je důvodem pro tzv. komplexní léčbu, ve které hraje důležitou roli léčba systémová. Jen ve zcela výjimečně příznivých případech můžeme tuto léčbu vynechat. Metody systémové léčby (chemoterapie, hormonální léčba a nastupující léčba genová) patří do oboru klinické onkologie, stejně tak radioterapie prsu po konzervativní léčbě nebo axily či jizvy po mastektomii patří radioterapeutům. Přehled této léčby již přesahuje záměr tohoto sdělení.
Literatura
- Bland, K.I., Copeland III, E.M.: The Breast, Comprehensive Management of Benign and Malignant Diseases, 2nd Edition, W.B. Saunders Company, 1998.
- Bland, K.I., Souba, W.W., Copeland, E.M.: Surgery for Benign and Malignant Disease of the Breast: Indications and Techniques. In: Oncological Surgery, 1995, s. 181-229.
- Donegan, W.L., Sprat, J.S., (Eds.): Cancer of the Breast. W.B. Saunders Company, 1995.
- Dupont, W.D., Page, D.L.: Breast cancer risk associated with proliferative disease, age at first birth and family history of breast cancer. Am. J. Epidemiol., 125, 1987, s. 796-799.
- Fechner, R.E., Mills, S.S.: Breast Pathology. Benign proliferations, atypias and in situ carcinomas. ASCP Press, Chicago, 1990.
- Harris, J.R., Lippman, M.E., Morrow, M., Hellman S., (Eds.): Diseases of the Breast. Lippincott-Raven Publishers, Philadelphia, 1996.
- Millis, R.R., Girling, A.C.: The Breast. In: Sternberg S.S., (Ed.): Diagnostic surgical pathology. Raven, New York, 1989, s. 253-313.
- Morrow, C.P., Curtin, J.P.: Gynecologic Cancer Surgery, Churchill Livingstone, 1996.
- Page, D.L., Anderson, TJ.: Diagnostic Histopathology of the Breast, Churchill Livingstone, Edinburgh, 1987.
- Page, D.L.: The woman at high risk for breast cancer. Surg. Clin. North. Am., 76, 1996, 2, s. 221-230.



